人体细胞内蛋白质对维持细胞正常功能发挥着至关重要的作用。细胞内异常的蛋白质或蛋白质水平紊乱会引起包括癌症、糖尿病、自身免疫性疾病、炎症和神经退行性疾病等在内的许多疾病。细胞内存在一个高度调控的泛素-蛋白酶体系统(UPS),可以及时清除胞内异常或者多余的蛋白质,是保持细胞内蛋白质动态平衡从而维持机体正常生理状态的重要途径之一。
泛素由76个氨基酸组成,是一种广泛分布于真核生物体内的高度保守性多肽。在细胞内的UPS系统中,通过三个序贯的生物学反应,泛素化酶(E1活化酶、E2结合酶以及E3泛素连接酶)将若干个泛素依次依序连接到底物蛋白上形成泛素链,对底物蛋白质做标记。随后,被标记的蛋白质被转运到胞浆内的蛋白酶体进行降解。
发现UPS系统的三位科学家Aaron Ciechanover、Avram Hershko和Irwin Rose共同分享了2004年诺贝尔化学奖。
2004年诺贝尔化学奖获得者
https://www.nobelprize.org/prizes/chemistry/2004/summary/
Irwin Rose

Aaron Ciechanover

Avram Hershko
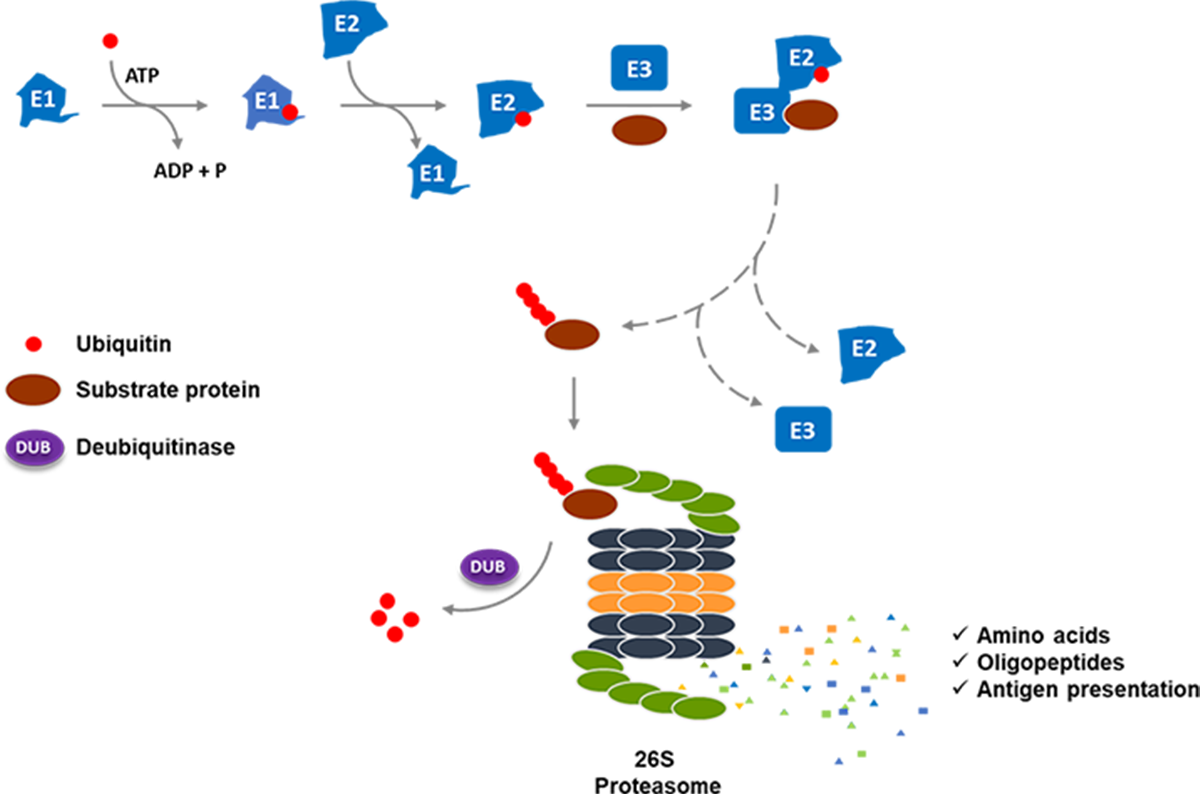
蛋白质泛素化-蛋白酶体降解系统包括若干个主要步骤:1)对底物蛋白质的泛素化标记; 2)对被泛素标记的底物蛋白质进行识别和转运;3)被泛素标记的底物蛋白质在26S蛋白酶体中的降解;和4)泛素的解离(去泛素化)和循环再利用。就底物蛋白质的泛素化而言,该过程分三步:首先E1活化酶将泛素活化,随后将活化的泛素转移给E2结合酶, 接下来E3泛素连接酶将结合在E2上的泛素转移到底物蛋白的赖氨酸氨基基团或是已附着到底物蛋白的泛素单元上。最终,被贴上泛素链标签的底物蛋白被转运至26S蛋白酶体降解,而泛素本身在去泛素化酶(DUBs)的作用下被回收再利用。
图1. 泛素-蛋白酶体系统通道
泛素-蛋白酶体通道几乎对细胞生物学的每一个方面都是必不可少的,广泛参与多种生物学活动,如信号传导、免疫应答、细胞凋亡、DNA损伤修复、基因转录调节、细胞周期调控、NF-κB活化等。
泛素-蛋白酶体系统的发现,为创新药物的开发提供了一个全新的舞台。例如,我们可以对泛素-蛋白酶体信号通道进行重编程,劫持E3泛素连接酶,对传统上无法靶向的致病蛋白质进行泛素化并予以降解,达到治疗疾病的目的。
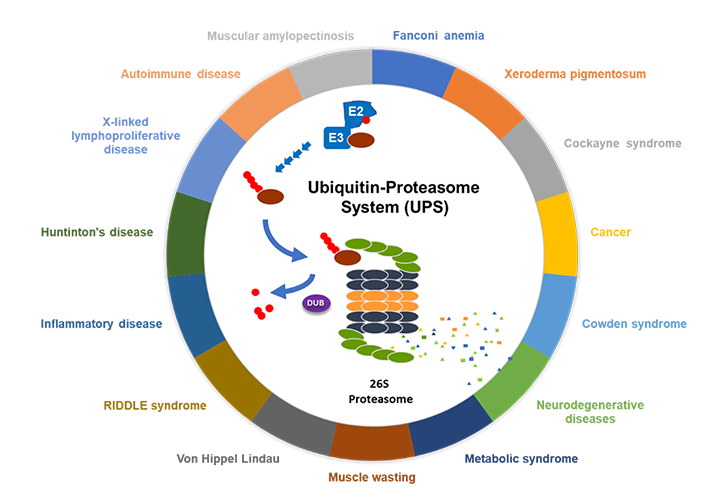
图2. 泛素-蛋白酶体系统与多种人类疾病有关
近年来的研究证明,免疫调节类小分子药物沙利度胺及其衍生物(包括来那度胺和泊马度胺)通过作用于靶点cereblon(CRBN,一种含442个氨基酸的蛋白质),可以有效调节E3泛素连接酶复合物(CRL4CRBN)的信号通道并改变底物蛋白的特异性,从而导致新的、非固有的底物蛋白质被泛素化和降解。其中被详细确证的CRL4CRBN E3泛素连接酶复合物的新底物蛋白包括Ikaros (IKZF1)、Aiolos (IKZF3)、CK1α 以及GSPT1等。Ikaros和Aiolos是Ikaros锌指转录因子家族中的两个重要成员,与B淋巴细胞的发育和增殖密切相关。度胺类药物通过重编程E3泛素连接酶复合物CRL4CRBN信号通路对Ikaros和Aiolos等新底物蛋白质的泛素化降解在医学及临床领域产生了广泛深远的影响,为骨髓瘤、淋巴瘤等血液疾病的治疗带来了革命性的改变。
通过新型小分子药物调节E3泛素连接酶复合物CRL4CRBN的底物特异性来消除致病蛋白,特别是消除那些缺乏完整的催化中心、不适合用小分子药物来抑制其酶学活性的致病蛋白,在创新药物开发领域具有巨大潜力和广阔前景。

为了更好的呈现效果,移动端请竖屏浏览

为了更好的呈现效果,移动端请竖屏浏览